Vous vous intéressez à la nutraceutique et souhaitez pouvoir décoder toutes les étiquettes et comprendre la signification des notations abstraites et mystérieuses qu’elles comportent ? Alors, cet article est fait pour vous ! Nutrixeal vous propose un cours accéléré de nomenclature chimique, illustré autant que possible d’exemples concrets, qui vous permettront de mieux appréhender les spécificités de vos compléments alimentaires favoris.
L/D, R/S, cis/trans, (+)/(-)… Il y a parfois de quoi s’y perdre dans les notations scientifiques des actifs nutraceutiques. Pourtant, ces précisions ont généralement une importance capitale pour l’activité biologique et donc l’efficacité de ces molécules ! Nutrixeal vous propose ici de faire le point sur ces notations, pour vous aider dans le choix de vos compléments alimentaires.
Ces notations scientifiques peuvent parfois mener à des explications très pointues. L’équipe scientifique de Nutrixeal a essayé de vulgariser le plus possible pour vous fournir un maximum d’informations tout en conservant une haute qualité scientifique. Nous vous invitons donc à vous laisser guider au fil de votre lecture sur les pistes de la chimie des nutriments !
Sommaire de l’article
La chiralité, une des grandes énigmes de la vie !
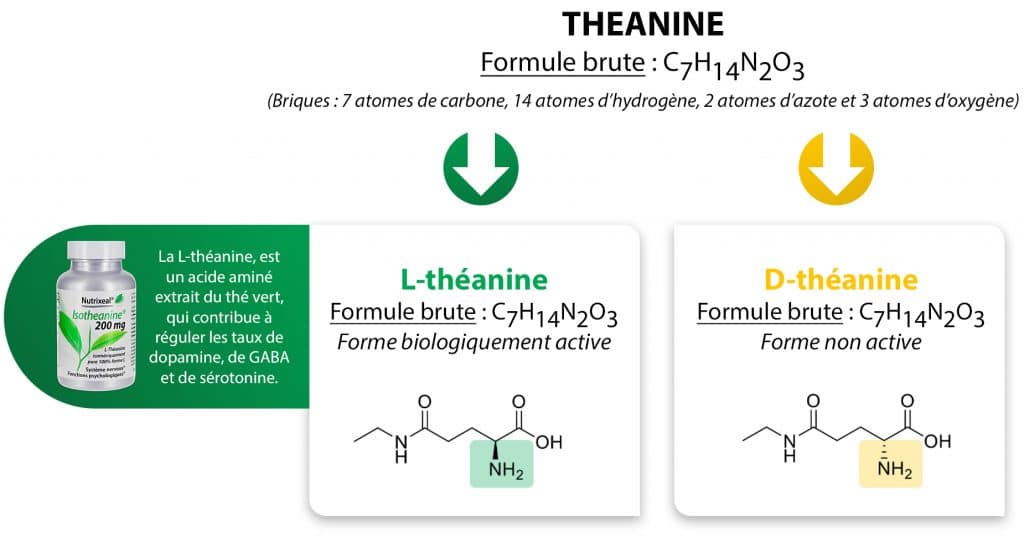
Les couples de notations que nous allons présenter ici servent tous à qualifier des molécules ayant la même formule brute, c’est-à-dire les mêmes briques (exemple : C7H14N2O3 pour la théanine), mais des formes différentes (exemple : L-théanine / D-théanine).
Deux molécules ayant la même formule brute mais qui diffèrent par l’arrangement spatial de leurs atomes sont appelées « isomères » ou « stéréoisomères ».
Les « énantiomères » sont des cas particuliers d’isomères ayant la propriété d’être l’image l’un de l’autre dans un miroir plan sans être superposables. Votre corps possède également cette propriété… votre main droite n’est pas superposable à la gauche et pourtant elles sont, toutes deux, image l’une de l’autre.
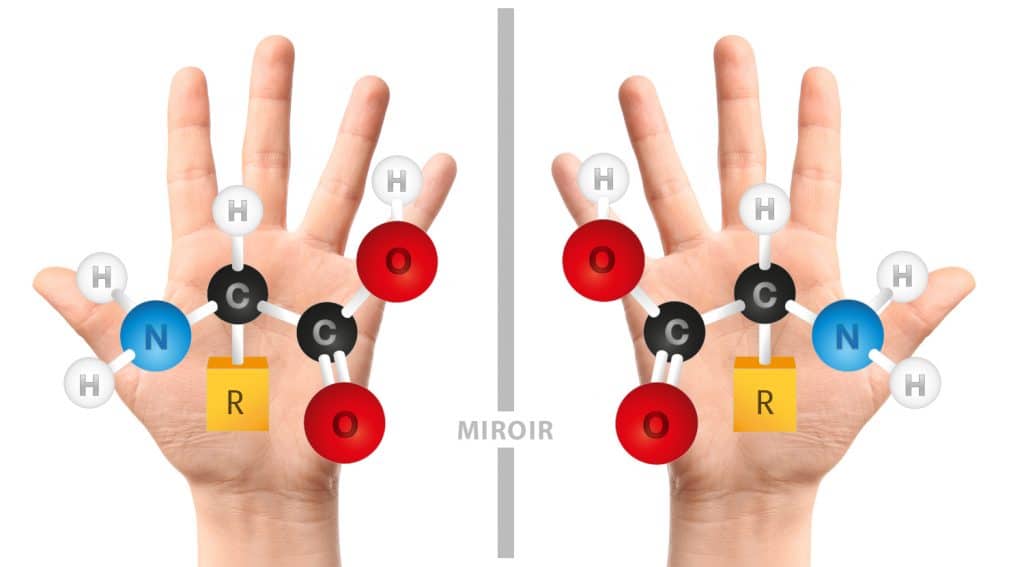
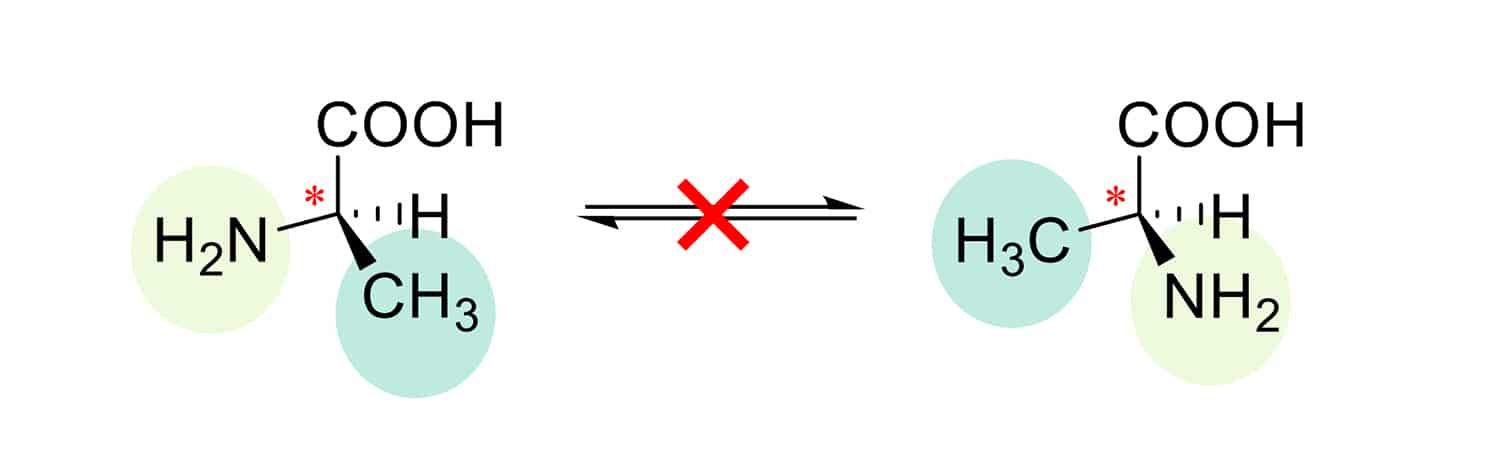
Les molécules qui sont des énantiomères sont dites « chirales ». Elles ont la particularité de posséder des propriétés physico-chimiques identiques (masse, point de fusion, solubilité…). Nous pouvons aller beaucoup plus loin en affirmant que la chiralité est à la base même de la vie sur terre. Notre corps est en effet construit de différentes briques élémentaires chirales ; les exemples les plus connus du grand public sont les acides aminés ou les sucres.

« Pour les petites molécules comme pour les plus grandes (protéines, etc.), la conformation spatiale joue un rôle déterminant dans leur activité biologique. Deux isomères peuvent en effet avoir des effets radicalement différents sur l’organisme ».
Pour aller plus loin et comprendre l’importance de connaître la chiralité de nos composés nutraceutiques, nous vous invitons à lire la triste histoire du thalidomide (Piste verte n°1).

Le thalidomide :
triste histoire d’un médicament chiral
La nécessité d’évaluer la sécurité des médicaments est apparue au début du XXème siècle à la suite d’accidents thérapeutiques, voire à des tragédies comme ce fut le cas pour le thalidomide. Le thalidomide est le premier médicament à avoir été reconnu comme tératogène pour l’espèce humaine, c’est-à-dire induisant des malformations embryofœtales lorsqu’il est pris par une femme enceinte.
Commercialisée dans les années 50 sous sa forme racémique (mélange équimolaire des deux énantiomères (R)-thalidomide et (S)-thalidomide), ce médicament était notamment prescrit chez les femmes enceintes en tant qu’hypnotique (sédatif) et antiémétique (antinauséeux). Tragiquement appelés les « bébés thalidomide », les nourrissons de ces mères traitées ont présenté de graves malformations congénitales avec notamment des phocomélies (atrophie des membres, mains et pieds prenant racine directement sur l’épaule ou la hanche).
On connaît aujourd’hui les raisons de ce drame qui fit 15 000 victimes dans le monde : si l’énantiomère (R) possède un réel effet thérapeutique chez les femmes souffrant de nausées, sa forme énantiomérique de configuration (S) induit un effet tératogène chez le fœtus.
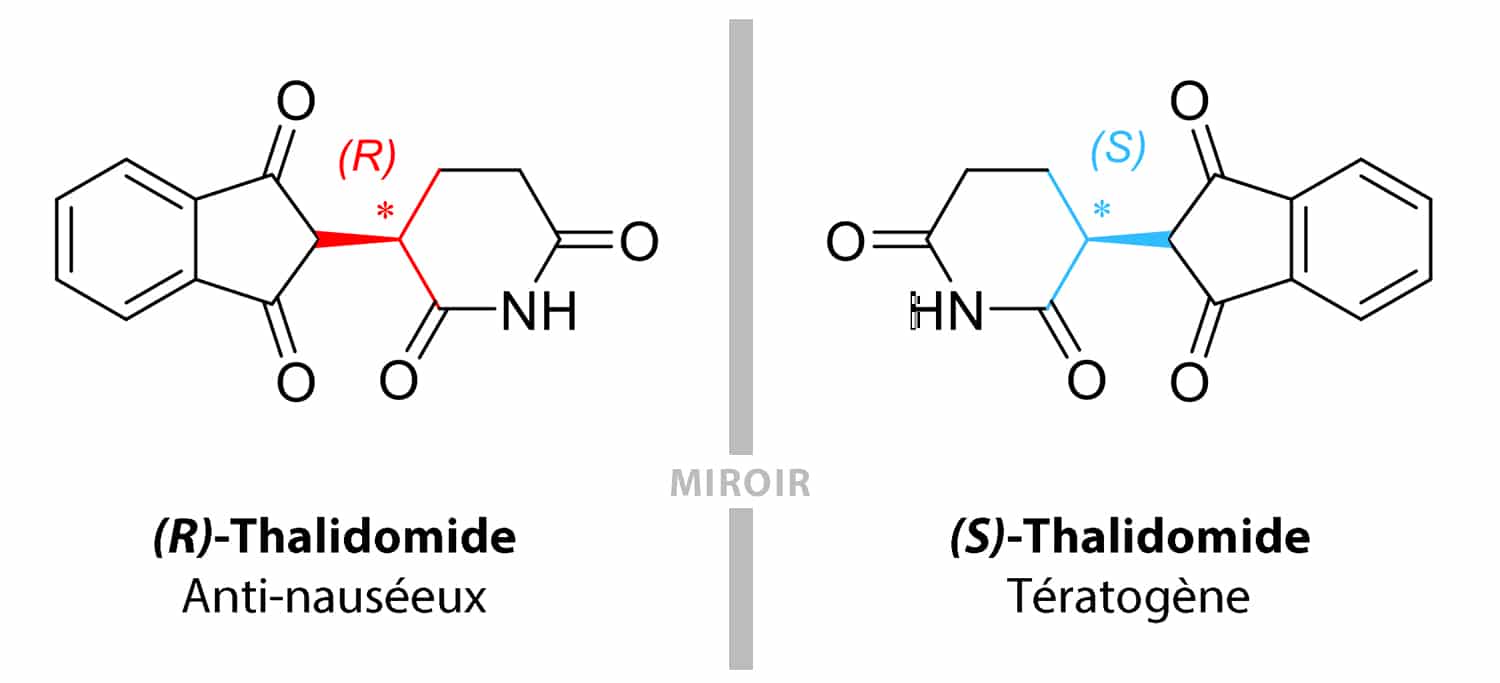
Depuis la triste histoire du thalidomide, la législation préconise le développement d’un médicament sous forme énantiomériquement pure (présence d’un seul énantiomère à 100% de pureté), sauf si le mélange racémique présente des avantages thérapeutiques.
Savoir dessiner une molécule : principe de base pour l’apprenti biochimiste que vous êtes !
Savoir représenter et nommer une molécule est essentiel pour dissocier deux molécules chimiquement semblables, à savoir deux énantiomères. Les scientifiques ont ainsi défini des règles pour pouvoir visualiser les molécules en tenant compte de leur agencement spatial ; les deux représentations dans l’espace les plus couramment utilisées sont la projection de Cram et la représentation de Fisher (très utilisée pour les acides aminés).
Pour aller plus loin : Vous souhaitez comprendre et apprendre à dessiner une molécule selon les représentations de Cram et Fisher… aventurez-vous donc sur la piste rouge n°2.

Projection de Cram vs Représentation de Fisher
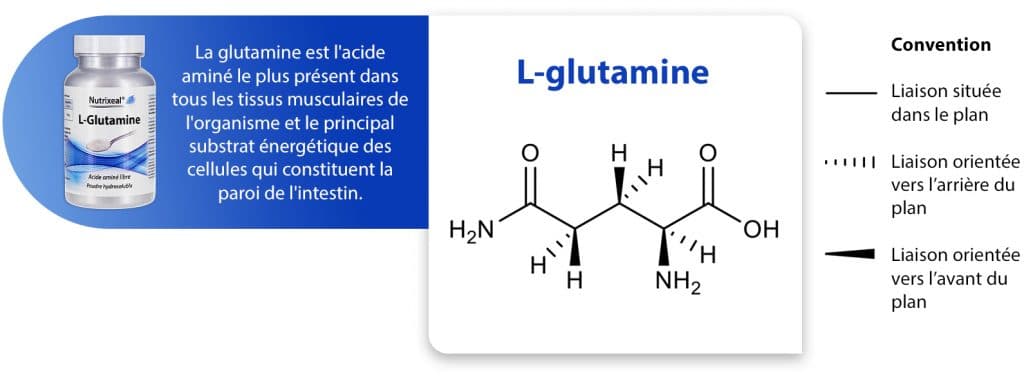
La représentation en perspectives (représentation de Cram) du carbone tétraédrique (possédant 4 substituants) place deux substituants dans le plan (liaisons notées en traits pleins), les deux autres étant respectivement en avant et en arrière du plan de la feuille. Les cônes pleins représentent des liaisons moléculaires dirigées vers l’observateur. Les cônes hachurés représentent des liaisons moléculaires s’éloignant de l’observateur.
La projection de Fisher est principalement utilisée pour représenter les acides aminés et les sucres, structures comportant plusieurs carbones asymétriques (c’est-à-dire un carbone substitué par quatre motifs différents).
De façon générale, le composé est représenté en projection de Fisher sous la forme d’une croix avec la chaîne carbonée la plus longue placée à la verticale. La fonction la plus oxydée, généralement la fonction acide carboxylique COOH pour les acides aminés et la fonction aldéhyde CHO pour les sucres, est placée en haut. Les liaisons horizontales (bâtons droits) sont en avant du plan de la feuille. Les liaisons verticales sont dans le plan ou en arrière du plan de la feuille.
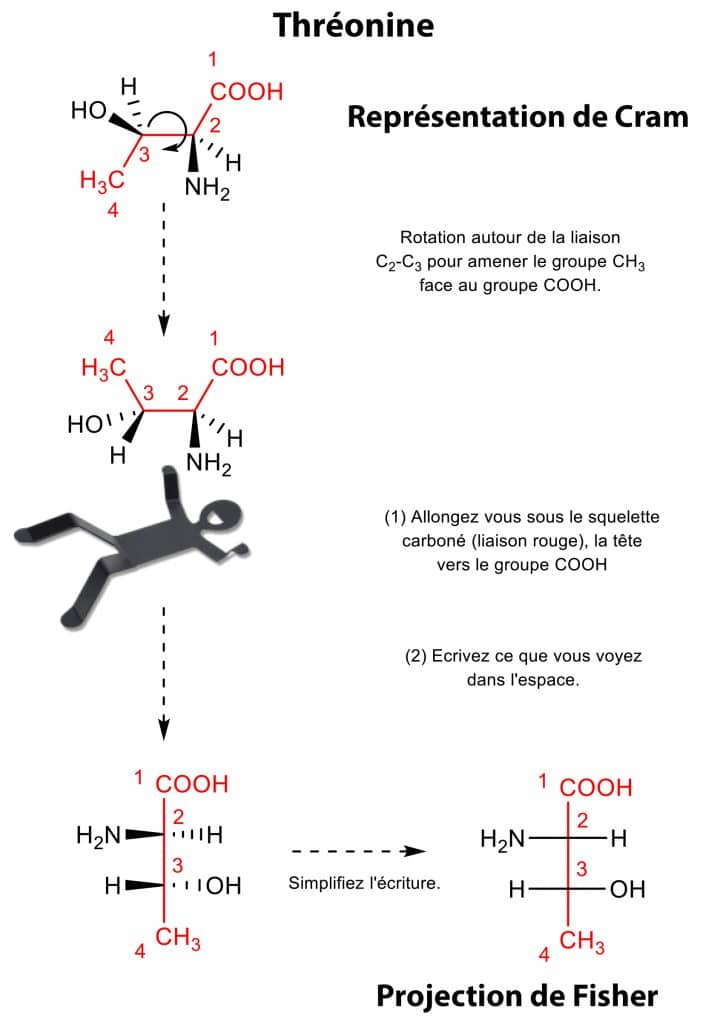
Vous allez mieux comprendre avec notre exemple sur la thréonine qui est un acide aminé essentiel, c’est-à-dire qui doit être apporté par l’alimentation. Tout d’abord, il vous faut représenter la thréonine en représentation de Cram. Repérez ensuite la chaîne la plus longue (en rouge) et disposez les groupements terminaux C1 et C4 en vis-à-vis (du même côté, en haut de la feuille). Maintenant un peu d’imagination et de sport intellectuel ! Imaginez que vous vous allongez sous la molécule dans l’axe du squelette carboné (en rouge), face à la liaison C2-C3 et placez votre tête du côté de la fonction la plus oxydée, à savoir ici l’acide carboxylique COOH. Vous voyez ainsi la chaîne carbonée verticale et les groupes C1 et C4 loin de vous (à l’arrière). Les autres substituants de C2 et C3 pointent en revanche vers vous. Ecrivez ainsi ce que vous visualisez dans l’espace, les liaisons à droite et à gauche de l’axe principal en rouge.
Il vous suffit ensuite de simplifier l’écriture en notant toutes les liaisons en traits pleins.
Pour décrire précisément la conformation spatiale des molécules, il convient en théorie d’utiliser la nomenclature IUPAC (International Union of Pure and Applied Chemistry), ensemble de règles permettant de nommer précisément chaque molécule étudiée. Toutefois, celle-ci étant tellement compliquée à maîtriser, elle est de moins en moins utilisée, même par les chimistes, qui lui préfèrent les noms usuels des molécules, associés à leur numéro CAS (Chemical Abstracts Service).
Par conséquent, plusieurs noms peuvent désigner la même molécule, ce qui peut être de nature à complexifier les choses, surtout lorsque l’on est novice en chimie. Pour y voir plus clair, le plus simple (si l’on maîtrise un peu l’anglais) est de consulter la base de données américaine Pubchem. Cette base de données répertorie, pour chaque molécule, l’ensemble de ses identifiants (noms, numéro CAS, formule brute, masse moléculaire, structure spatiale, etc.). Pour les molécules les plus étudiées, la base Pubchem explique même brièvement d’où vient cette molécule (plante d’origine, etc.) et quel est l’état des connaissances sur son activité biologique.
Pour pouvoir distinguer deux stéréoisomères par leurs noms respectifs, nous utilisons des stéréodescripteurs (R/S, cis/trans, D/L) qui sont ajoutés devant le nom de chaque composé. Dans la suite de cet article, nous nous appuierons sur des exemples de principes actifs commercialisés chez Nutrixeal pour que vous compreniez tout l’intérêt d’un isomère par rapport à un autre en nutraceutique.
La stéréoisomérie et ses règles !
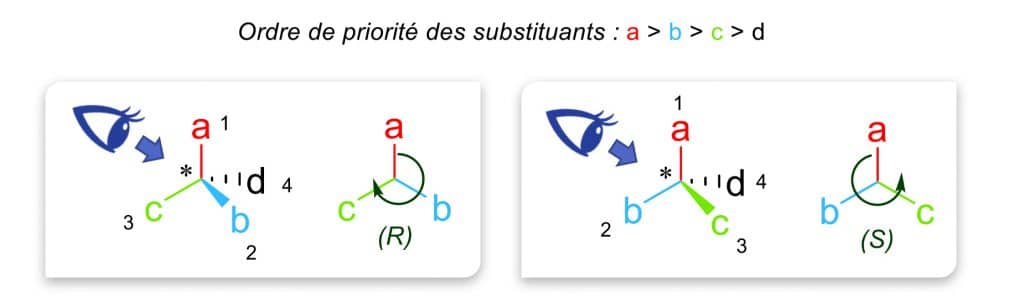
Avant toute chose et afin que vous compreniez mieux les principes régissant les différents stéréodescripteurs qui vont suivre, il nous paraît important de rappeler une nomenclature usuelle essentielle pour un chimiste : les règles de Cahn, Ingold et Prelog (CIP). Ces règles permettent d’établir une priorité des 4 substituants autour d’un carbone asymétrique. La démarche consiste à classer par ordre de priorité décroissante les atomes ou groupes d’atomes fixés sur un carbone asymétrique ou sur chaque atome de carbone d’une double liaison C=C.
La nomenclature (R) ou (S) : configuration d’un carbone asymétrique
La nomenclature (R) et (S) est utilisée pour qualifier l’arrangement spatial des atomes d’un carbone asymétrique. Les groupes doivent au préalable être classés par ordre de priorité selon les règles CIP.
Dans le cas d’un carbone asymétrique, deux types d’arrangement sont possibles autour de l’atome central. Après avoir représenté la molécule selon la représentation de Cram, l’observateur place son regard dans l’axe du plan avec le substituant le moins prioritaire en arrière du champ de vision :
- si l’arrangement des substituants a, b et c tourne dans le sens des aiguilles d’une montre (vers la droite), nous parlerons de configuration (R) (du latin rectus, qui signifie « droit ») ;
- si l’arrangement des substituants a, b et c tourne dans le sens anti-horaire (vers la gauche), il s’agira de la configuration (S) (du latin sinister, qui signifie « gauche » ).
Exemple de notre antioxydant actif sous sa forme (R) : l’acide (R)-alpha-lipoïque
L’acide alpha-lipoïque possède un carbone asymétrique, ce qui lui permet d’exister sous deux formes énantiomériques : l’acide (R)-alpha-lipoïque et l’acide (S)-alpha-lipoïque.
La forme (R), naturellement produite par l’organisme, est un antioxydant endogène majeur présent dans toutes nos cellules et préférentiellement au sein des mitochondries.
La forme (S) ne peut être obtenue que de façon artificielle et serait moins active que son analogue (R).
De façon générale, lorsque l’on parle de l’acide alpha-lipoïque, sans précision sur la configuration (R) ou (S), il s’agit de la forme synthétique racémique (mélange équimolaire des deux énantiomères).
Pendant de nombreuses années, les coûts élevés ainsi que la difficulté à isoler les deux isomères, ont conduit à la commercialisation du mélange racémique. Cependant, les progrès réalisés en matière de méthodes de séparation énantiosélective, ont permis de mettre à disposition la forme (R) énantiomériquement pure.
La forme (R) pure serait trois fois plus efficace que le mélange racémique (R/S). C’est pourquoi, chez Nutrixeal, nous avons fait le choix de ne commercialiser l’acide (R)-alpha-lipoïque que sous sa forme énantiomériquement pure.
Pour aller plus loin : Afin de bien comprendre ce qu’est un carbone asymétrique, nous vous proposons un petit récapitulatif de cette notion essentielle (piste verte n°3).

Le carbone asymétrique : base de l’hétérogénéité du vivant
Un carbone asymétrique est un atome de carbone lié à quatre substituants différents. Nous utilisons un astérisque (*) pour repérer cet atome au sein d’une molécule.
Présent dans de nombreux fruits et légumes, l’acide ascorbique plus connu sous le nom de vitamine C (acide L-ascorbique) possède deux atomes de carbone asymétriques dans sa structure.
Pour en savoir plus sur les bienfaits nutritionnels de la vitamine C, nous vous invitons à lire l’article « Vitamine C : un bouclier antioxydant au cœur de nos cellules ».
La nomenclature cis/trans
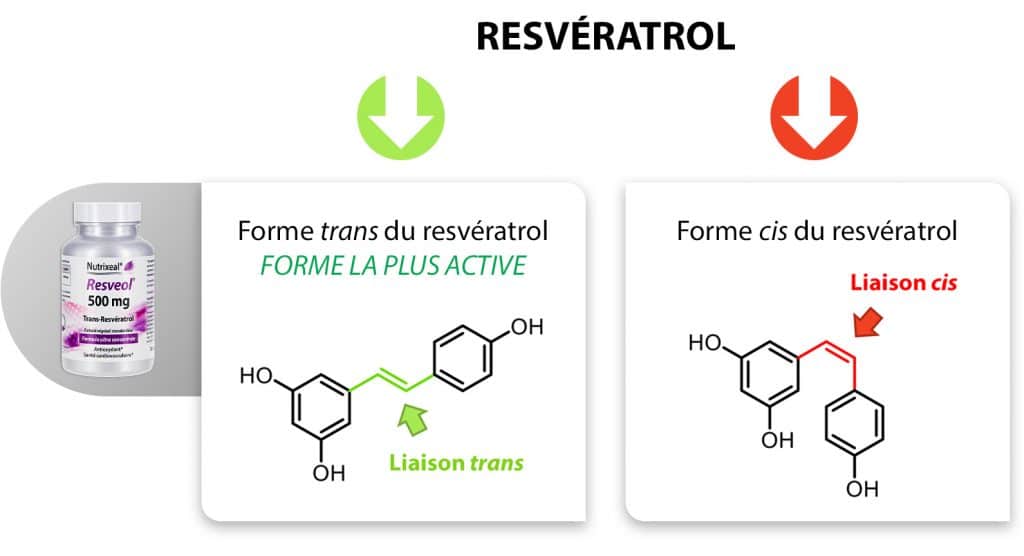
Cette nomenclature est utilisée pour décrire la disposition relative de groupes portés par chacun des atomes de carbone d’une double liaison C=C. C’est dans ce contexte que de nombreux composés naturels ont été identifiés sous la nomenclature cis/trans. Deux substituants sont décrits comme étant en position cis ou trans l’un par rapport à l’autre s’ils sont respectivement du même côté ou de part et d’autre de la double liaison C=C.

Si le terme trans peut parfois effrayer en l’associant à tort au terme transgénique ou aux graisses trans, il n’en est rien en nomenclature systématique. Le terme trans permet simplement d’être rigoureux sur la configuration du composé commercialisé
Chez Nutrixeal, nos plus grands exemples sont le trans-resvératrol et la vitamine K2. Vous les retrouverez sous la forme de nos compléments alimentaires Resveol et PhysioK2.
Le complément Resveol : source de trans-resvératrol
Le resvératrol est un antioxydant, qui contribue à protéger contre le stress oxydant et à maintenir une bonne santé cardiovasculaire. Chez Nutrixeal, nous commercialisons exclusivement du trans-resvératrol, qui est la forme la plus active de resvératrol. La forme cis-resvératrol présenterait une bioactivité sept fois moins importante que son analogue trans.
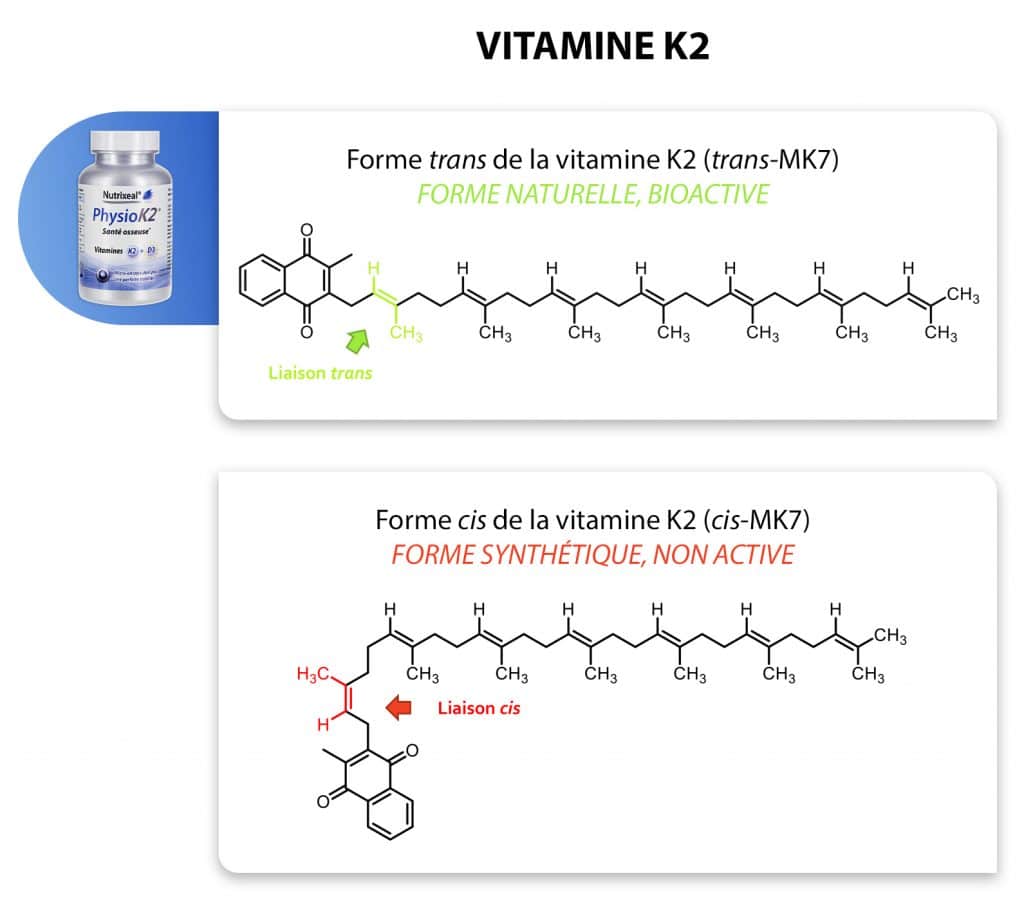
Le complément PhysioK2 : source de vitamine K2
Notre complément PhysioK2, enrichi en vitamine D et K, contribue au maintien d’une ossature et d’une coagulation sanguine normale. Cette nouvelle formule de haute qualité en vitamine K2 (ménaquinone 7, MK-7), vous propose une forme active 100 % naturelle de configuration trans. Le MK-7 a en effet la particularité de présenter deux formes d’isomères, cis et trans. Le trans-MK-7 est la forme naturellement présente dans les aliments et qui agit au sein de l’organisme. L’isomère cis n’est pas bioactif (aucune propriété médicale).
Les configurations D et L : une spécificité caractéristique du vivant !
Les notations D et L sont fréquemment utilisées pour qualifier la stéréochimie des sucres et des acides aminés. Cette nomenclature est interprétée en visualisant les molécules selon une projection de Fisher. Une molécule appartient à la série D ou L selon la position droite ou gauche d’un substituant présent sur un de ses carbones asymétriques. Pour mieux comprendre cette spécificité, nous citerons un exemple dans le cas des sucres et un exemple appartenant à la famille des acides aminés.
Cas des sucres
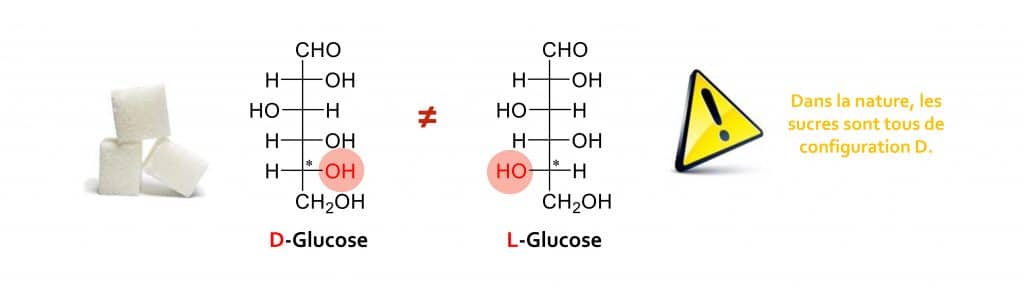
Prenons le cas du sucre le plus connu du grand public puisqu’il représente un des ingrédients stars de l’industrie agro-alimentaire… le GLUCOSE !
Le glucose existe sous la forme du D-glucose et du L-glucose. La configuration D est attribuée à l’isomère dont la fonction alcool (OH) portée par le carbone asymétrique (*) est disposée à droite dans la projection de Fisher. Inversement, le L-glucose a sa fonction OH à gauche.
Il est important de préciser qu’il faut toujours considérer la position de la fonction alcool OH portée par le carbone asymétrique le plus éloigné de la fonction la plus oxydée (ici la fonction aldéhyde CHO).
Cas des acides aminés
Dans le cas des acides aminés, c’est la position de la fonction amine NH2 qui permet de discriminer les deux configurations : D si elle est située à droite, et L si elle est à gauche.
Reprenons notre exemple de la thréonine. L’acide aminé sera D ou L selon que le groupement NH2 juxtaposant la fonction COOH (carbone appelé α-amine car en position α de l’acide carboxylique) est projeté à droite ou à gauche en projection de Fisher.
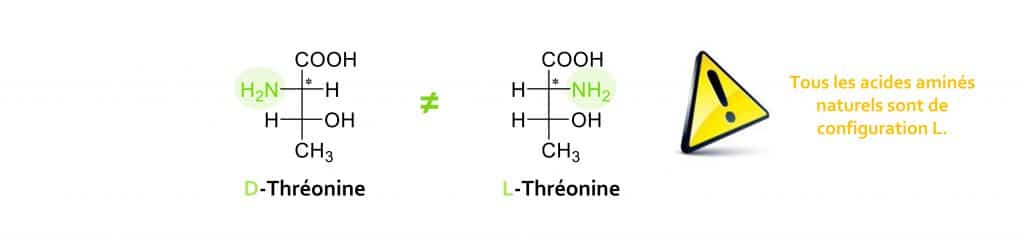
Tous les acides aminés commercialisés par Nutrixeal sont de forme L.
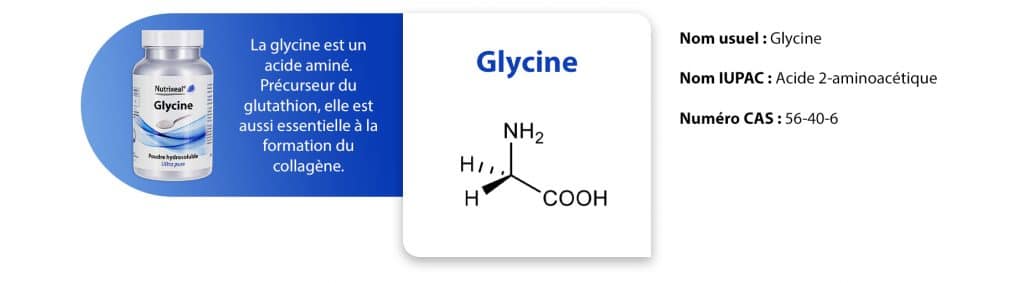
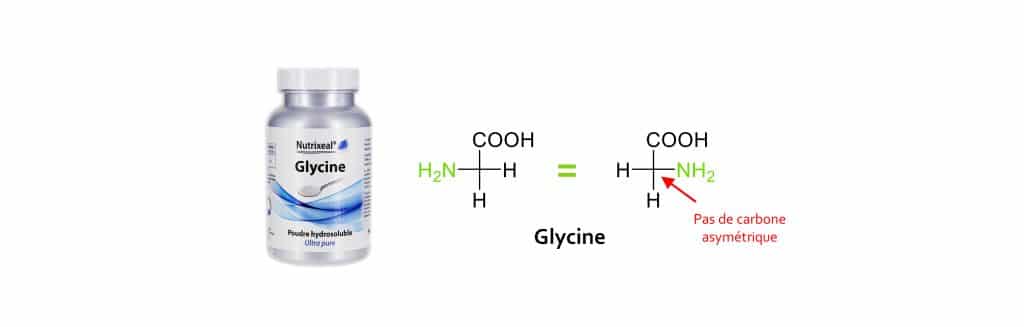
Cas particulier de la glycine
La glycine est un acide aminé essentiel. Précurseur du glutathion, elle est aussi essentielle à la formation du collagène. Si vous observez de plus près sa formule chimique, vous vous apercevrez que cet acide aminé a la particulier de ne pas avoir de carbone asymétrique (sur ses 4 substituants, deux sont identiques). La glycine n’est donc pas régie par les différentes règles citées ci-dessus et tout particulièrement par la configuration L ou D. Vous comprenez maintenant mieux pourquoi chez Nutrixeal, nous n’emploierons jamais le terme de L-glycine ou de D-glycine.
L’activité optique et le pouvoir rotatoire : notation (+) et (-)
Les molécules chirales ont la propriété de faire tourner le plan de polarisation d’un faisceau de lumière polarisée. Cette substance présente alors une activité optique, elles sont dites optiquement actives ou qu’elles ont un pouvoir rotatoire. Les molécules qui font tourner le plan de polarisation de la lumière polarisée :
- vers la droite, sont qualifiées de dextrogyres (d). Leur pouvoir rotatoire est positif et leur nom sera précédé du signe (+),
- vers la gauche, sont qualifiées de levogyres (l). Leur pouvoir rotatoire est négatif et leur nom sera précédé d’un signe (-).

Il ne faut pas confondre les notations d et D, l et L ! Les stéréodescripteurs décrits précédemment et utilisés pour décrire des stéréoisomères sont basés sur des conventions. Ils sont indépendants du pouvoir rotatoire.
Ainsi, un composé de configuration D peut être dextrogyre (d) ou lévogyre (l). Seule la polarimétrie permet de déterminer le signe du pouvoir rotatoire d’une substance. De plus, il n’existe pas de relation entre l’activité optique (+) ou (-) et la configuration (R) ou (S) d’un carbone asymétrique. Nous pouvons par exemple citer la vitamine C ou l’acide (+)-L-ascorbique qui est de configuration L et qui dévie la lumière vers la droite (+). Il est donc optiquement actif de façon dextrogyre. Dans ce cas, on peut facilement saisir qu’il n’y pas de lien entre les configurations D ou L et le sens du pouvoir rotatoire (+) ou (-). Les règles de nomenclature IUPAC encouragent ainsi la notation (+) et (-) plutôt que (d) et (l), ce qui évite toute ambiguïté.
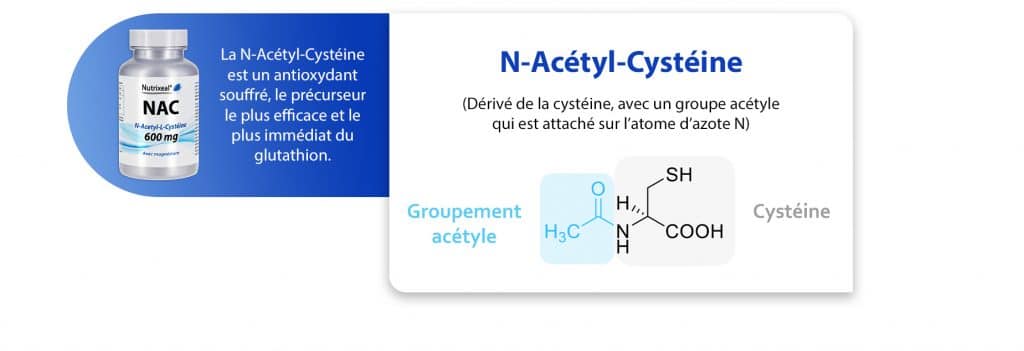
Notation N en préfixe d’une substance
Vous observerez parfois que le nom de certains de nos composés possède un N majuscule en préfixe ; c’est par exemple le cas de la N-Acétyl-Cystéine (NAC) ou de la N-Acétyl-Glucosamine (NAG). Cette notation permet d’affiner la nomenclature IUPAC d’un composé puisqu’il indique le site de fixation d’un groupement sur la molécule. En d’autres termes, dans les cas des molécules NAC et NAG, elle précise que le groupement chimique acétyle est porté par l’atome d’azote N des molécules.
Toute l’équipe scientifique de Nutrixeal espère que cet article vous aura éclairé sur les diverses notations scientifiques utilisées pour nommer nos produits. N’hésitez pas à nous faire parvenir toutes remarques, et si d’autres interrogations subsistent, n’hésitez pas à nous contacter ; l’équipe scientifique Nutrixeal se fera un plaisir de répondre à vos questions. Vous êtes nombreux à vous interroger sur les méthodes de séparation et d’identification des molécules bioactives chirales. A cet effet, nous publierons prochainement un nouvel article sur cette thématique… un autre challenge scientifique !
Auteurs
Dr. Laurène Da Costa, PhD, docteur en chimie thérapeutique
Dr. Mathilde Clier, PhD, docteur en biologie cellulaire



très instructif et clair