La glycine est le plus petit acide aminé naturel, avec pour chaîne latérale un unique atome d’hydrogène. Elle fait partie des 20 acides aminés qui constituent les briques de base des protéines synthétisées par notre organisme : on dit que la glycine est un acide aminé « protéinogène ».

Caractéristiques de la glycine
Définition et structure
| Propriétés chimiques | Propriétés physiques | Propriétés biochimiques |
| Formule brute : C2H5NO2 | T° de fusion : 232-236 °C | pH isoélectrique : 5,97 |
| Masse moléculaire : 75,07 g/mol | pKa groupe carboxyle : 2,4 | |
| pKa groupe amine : 9,7 |
La poudre de glycine est formée de cristaux de couleur blanche.
La glycine est soluble dans l’eau jusqu’à une concentration de 225 g/L.
Alors que dans le monde vivant, tous les acides aminés sont des molécules chirales de forme « L », la glycine fait figure d’exception : elle est le seul acide aminé « achiral » (c’est-à-dire non chiral). Par conséquent, la glycine ne possède aucune configuration L ou D. S’il est nécessaire de le préciser pour les autres acides aminés, nul besoin de mentionner la configuration pour la glycine.

La notation L-glycine est donc un abus de langage.
Pour en savoir plus sur les molécules chirales, consulter notre dossier sur les notations scientifiques.
En 1820, le chimiste français H. Braconnot isola pour la première fois la glycine en portant à ébullition de la gélatine et de l’acide sulfurique. La glycine a un goût doux et sucré comme le glucose. Ces propriétés gustatives ont inspiré son nom puisque le terme glycine dérive du mot grec « glykys » signifiant « goût sucré ». A ce titre, la glycine est utilisée dans l’industrie agroalimentaire en tant qu’édulcorant ou exhausteur de goût (additif alimentaire E640).
La glycine est considérée comme un acide aminé protéinogène non essentiel sur le plan nutritionnel. Cependant, de nombreux rapports indiquent que la quantité de glycine produite chez l’Homme n’est pas suffisante pour combler toute l’activité métabolique. Il est donc de plus en plus admis que la glycine est un acide aminé semi-essentiel, dans la mesure où l’organisme n’est pas en mesure de totalement combler, de façon autonome, les besoins quotidiens en glycine.
La glycine, précurseur de nombreux composés
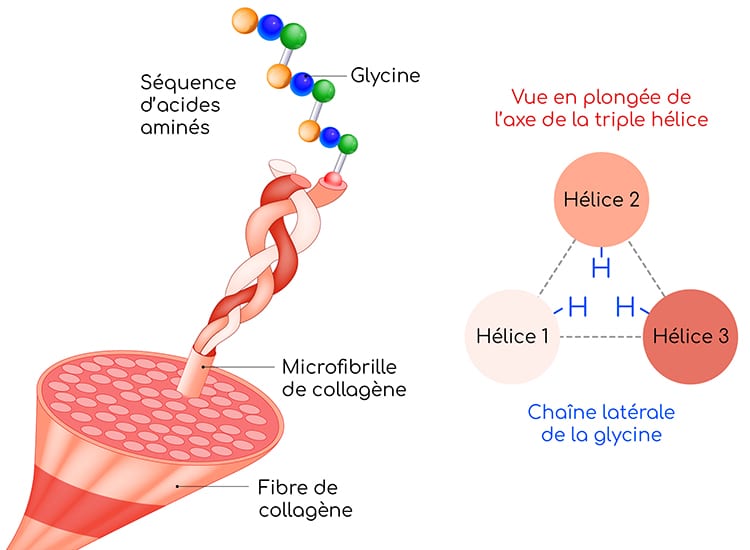
Dans l’organisme, la glycine intervient dans divers processus biologiques, dont le plus connu est la synthèse du collagène, particulièrement gourmande en glycine. La glycine est l’acide aminé majoritaire du collagène : 33 % des acides aminés formant une protéine de collagène sont des glycines (une glycine tous les trois acides aminés).
Les glycines contribuent au maintien des structures secondaire et quaternaire du collagène :
La glycine est également le précurseur de la synthèse de nombreux composés essentiels :
La glycine joue indirectement un rôle dans l’absorption et la digestion des vitamines liposolubles et des graisses en se conjuguant aux acides biliaires. Les acides biliaires sont produits dans le foie par oxydation du cholestérol. Ils sont ensuite conjugués avec un acide aminé de type glycine ou taurine. Plus de 98% d’entre eux sont conjugués ce qui augmente leur caractère amphipathique, propriété contribuant à rendre hydrosoluble les lipides alimentaires : une partie de la molécule est hydrophile, permettant leur solubilité dans l’eau, l’autre partie est hydrophobe, permettant la création de micelles pour absorber les graisses[3].
Dans le système nerveux central, la glycine intervient en tant que neurotransmetteur.
Quelques chiffres[4]
La glycine représente 11,5% des acides aminés du corps humain.
20% de l’azote total des acides aminés protéinogènes du corps humain proviennent de la glycine.
80% de la glycine est utilisée pour la synthèse des protéines.
Voies de biosynthèse de la glycine[2]
Chez l’homme, la glycine peut être synthétisée à partir de plusieurs précurseurs par un métabolisme inter-organes impliquant principalement le foie et les reins. Elle est principalement synthétisée à partir de :
La sérine et ses précurseurs sont les principaux contributeurs à la production endogène de glycine.
Les autres voies de biosynthèse contribuent à la production endogène de glycine dans une bien moindre mesure. La voie de biosynthèse à partir de la choline n’est effectivement pas prédominante car l’apport alimentaire en choline est très faible (400-500 mg/j). Cependant, cette voie est pertinente puisque la dégradation de la choline en glycine génère des groupes méthyles, essentiels dans les processus de méthylation cellulaire[5].
Sources alimentaires
Certains aliments sont réputés pour être riches en glycine. C’est notamment le cas des aliments riches en protéines comme les viandes, les poissons et les œufs.
L’aliment le plus riche en glycine reste cependant la gélatine dont le composant principal est le collagène.
Glycine et nutraceutique
Bienfaits et vertus de la glycine

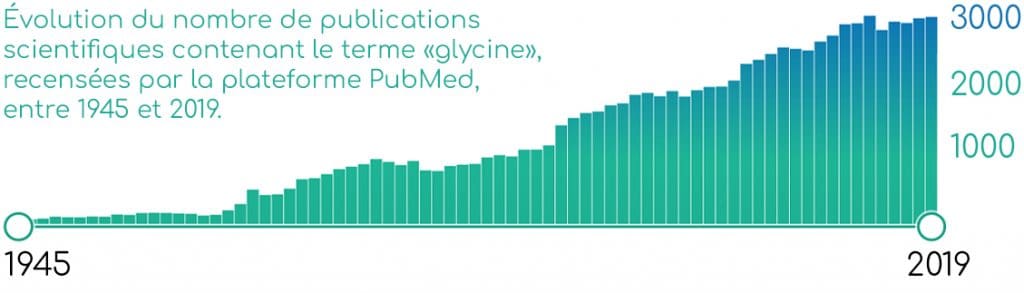
Malgré l’abondante littérature scientifique concernant la glycine et ses bénéfices santé, aucune allégation santé n’a encore été autorisée par l’EFSA en ce qui concerne cet ingrédient.
Critères de choix pour une supplémentation
Au fil du temps, nos habitudes alimentaires ont évolué engendrant ainsi une baisse significative des apports en glycine. Nos ancêtres avaient effectivement pour coutume de manger les parties des animaux riches en collagène comme les os, le cartilage et la peau. Nos besoins quotidiens en glycine n’ont pour autant pas diminué – environ 14,5 g glycine par jour (détails tableau ci-après). Même lors d’une consommation très riche en protéines, on observe un déficit important en glycine (jusqu’à 10 g par jour) : l’apport alimentaire ainsi que la synthèse endogène notamment à partir de la sérine ne suffisent effectivement pas à combler les besoins journaliers en glycine[6].
On estime que pour un adulte de 70 kg, la carence en glycine est de 10 g par jour.
Combler ce déficit par l’intermédiaire d’une supplémentation en glycine est une solution intéressant pour rétablir un taux optimal en glycine, alternative tout particulièrement intéressante pour les personnes suivants un régime faible en protéines comme c’est le cas des personnes végétariennes, végétaliennes ou végans.
| Besoins en glycine par jour | |
| Synthèse du collagène | 12 g |
| Synthèse des métabolites | 1,5 g |
| Synthèse d’autres protéines | 1 g |
| Total de la teneur minimale | 14,5 g |
La capacité du métabolisme humain à synthétiser de la glycine est insuffisante pour combler les besoins de cet acide aminé, précurseur de synthèse pour d’autres métabolites, et tout particulièrement pour le collagène.

Avis Nutrixeal sur la glycine
Nutrixeal propose une forme vegan de glycine 100 % pure et sous forme hydrosoluble.
La glycine utilisée par Nutrixeal est une matière première de très haute qualité, extrêmement pure. Nous la commercialisons sous forme poudre, car la glycine a naturellement une saveur agréable, neutre, légèrement sucrée.
Nota bene : notre glycine est 100% pure et ne contient pas de sucre !
Conseil d’emploi
Suivant les besoins, nous recommandons la prise de 4,5 ou 9 g de glycine par jour, soit 1 à 2 dosettes à dissoudre dans de l’eau ou un jus de fruits (1 dosette de 5 mL = 4,5 g de glycine).

En savoir plus sur les produits Nutrixeal associés :
Références
[1] Franco, R.; Schoneveld, O. J.; Pappa, A.; Panayiotidis, M. I. Arch. Physiol. Biochem. 2007, 113 (4–5), 234–258.
[2] Wang, W.; Wu, Z.; Dai, Z.; Yang, Y.; Wang, J.; Wu, G. Amino Acids 2013, 45 (3), 463–477.
[3] Monte, M. J.; Marin, J. J.; Antelo, A.; Vazquez-Tato, J. World J. Gastroenterol. 2009, 15 (7), 804.
[4] Razak, M. A.; Begum, P. S.; Viswanath, B.; Rajagopal, S. Oxid. Med. Cell. Longev. 2017, 2017, 1–8.
[5] Alves, A.; Bassot, A.; Bulteau, A.-L.; Pirola, L.; Morio, B. Nutrients 2019, 11 (6), 1356.
[6] Meléndez-Hevia, E.; de Paz-Lugo, P.; Cornish-Bowden, A.; Cárdenas, M. L. J. Biosci. 2009, 34 (6), 853–872.


