Les minéraux et oligoéléments, indispensables à notre santé, sont des incontournables en nutraceutique mais la qualité des produits proposés sur le marché est très hétérogène. Les formes chélatées sont les plus qualitatives, mais sélectionner un produit 100% chélaté reste encore à l’heure actuelle un challenge ! À s’y pencher de plus près, on se rend compte que certains fournisseurs, qui affirment proposer des formes 100% chélatées, sont finalement loin du compte…
À l’aide de la méthode TRAACS, le laboratoire Nutrixeal et son partenaire Albion® Minerals ont mené l’enquête sur les minéraux chélatés, et les résultats pourraient bien vous surprendre…

Minéraux et oligoéléments chélatés : de quoi s’agit-il ?
Indispensables au bon fonctionnement de l’organisme, les minéraux font partie des suppléments consommés, de manière occasionnelle ou régulière, par une grande partie de la population occidentale. Parmi toutes les formes possibles, les formes chélatées garantissent une bien meilleure assimilation et tolérance intestinale. La chélation protège par ailleurs les minéraux et oligoéléments de l’oxydation et permet de les véhiculer jusqu’à leurs cellules cibles.
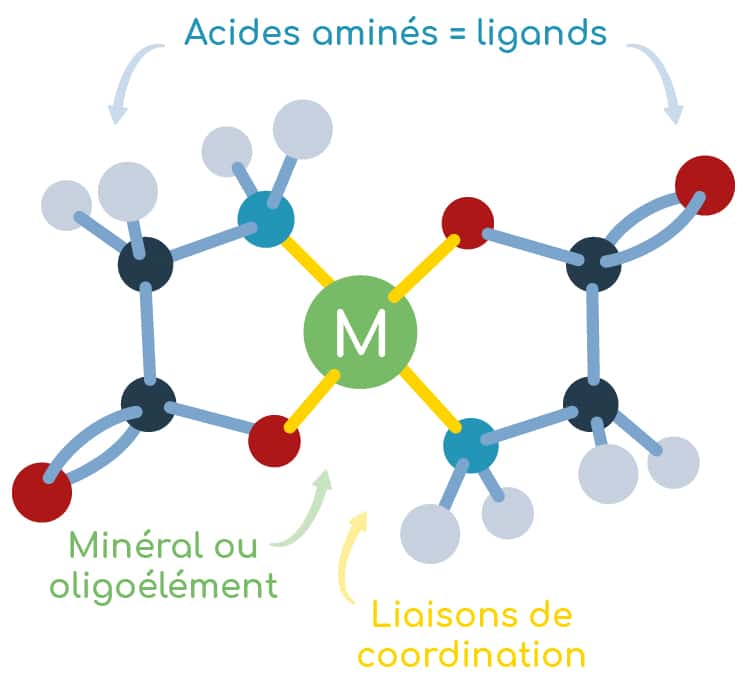
La chélation entre un métal et des acides aminés est un processus physico-chimique permettant de former un complexe où le métal est emprisonné au sein d’une cage formée par un ou plusieurs acides aminés. L’ensemble formé est appelé « chélate » et les acides aminés « ligands ».
À NOTER
Chélates d’acides aminés, oligoéléments chélatés, minéraux amino-chélatés… plusieurs noms scientifiques peuvent être utilisés pour désigner cette même famille de complexes métalliques.
POUR ALLER PLUS LOIN

Pourquoi et comment vérifier la qualité de chélation des minéraux ?
Les méthodes de production de chélates de minéraux sont connues depuis très longtemps, cependant nous nous sommes aperçus lors de nos recherches que bon nombre de produits disponibles sur le marché sont en réalité des formes minérales partiellement chélatées voire dénuées de chélation entre les acides aminés et le métal d’intérêt.
Conformément à sa charte qualité, le laboratoire Nutrixeal propose bien sûr uniquement des formes naturelles 100% chélatées. Pour garantir la qualité des minéraux et oligoéléments proposés dans sa gamme, Nutrixeal a choisi de travailler avec le leader mondial sur le marché des minéraux et oligoéléments chélatés, Albion® Minerals.
ALBION® MINERALS, PARTENAIRE NUTRIXEAL
Entreprise créée dans les années 50, Albion® Minerals bénéficie d’une forte expertise des formes minérales nutritionnelles hautement biodisponibles. Au fil des années, Albion® Minerals est devenu le spécialiste mondial des minéraux organiques – une expertise appuyée par de nombreuses études scientifiques et le dépôt de centaines de brevets. Albion® Minerals commercialise ainsi un grand nombre de minéraux (Mg, Fe, Cu, Zn…) sous forme d’acides aminés chélatés. Beaucoup d’autres producteurs (notamment en Asie) s’évertuent à challenger Albion® Minerals et à convoiter ses parts de marché.

POUR EN SAVOIR PLUS :
Les tests permettant de mesurer le degré de chélation d’un chélate d’acide aminé sont souvent très coûteux en temps et en énergie. Cela n’incite malheureusement pas les laboratoires à réaliser des contrôles qualité récurrents, et entretient le manque de discernement entre produits de qualité et bon nombre de pseudo-chélates malheureusement présents sur le marché.
Dans le cadre de sa démarche qualité, Albion® Minerals a choisi d’investir des ressources afin de développer des méthodes d’analyses rapides, fiables et efficaces, capables de caractériser et de quantifier le degré de chélation d’un minéral organique. Ils ont ainsi développé la méthode TRAACS (« The Real Amino Acid Chelate System »).
Grace à cette technologie, il est désormais possible de vérifier très facilement si des métaux comme le magnésium, le cuivre, le fer ou le zinc sont chélatés totalement ou partiellement à l’acide aminé associé.
LA MÉTHODE TRAACS, EN QUELQUES MOTS
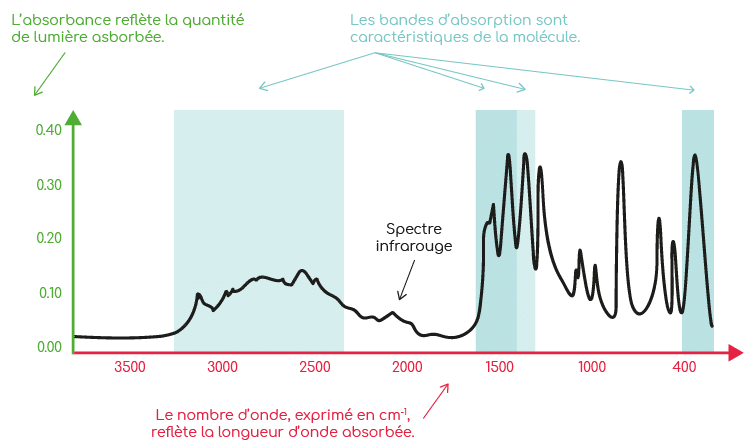
La méthode TRAACS est basée sur l’analyse infrarouge des chélates d’acides aminés. Chaque molécule absorbe de manière spécifique la lumière infrarouge. Avec ce type d’analyse, on obtient donc un spectre représentant des pics d’absorption différents selon le contenu du complexe analysé. Si un échantillon contient uniquement de la glycine libre, les pics d’absorption seront différents de ceux obtenus avec un échantillon contenant de la glycine chélatée à un métal (disparition ou déplacement de bandes d’absorption caractéristiques). La méthode TRAACS repose sur la comparaison des spectres d’absorption des acides aminés seuls, des chélates d’acides aminés et des produits à analyser.
La méthode la plus fiable pour valider la conformité d’un chélate est de calculer son rapport molaire qui définit le nombre de ligands fixés sur le métal. Un atome de métal doit idéalement être lié à deux molécules de ligands. Le rapport molaire optimal est ainsi de 2:1.

Quels résultats observe-t-on avec différents produits disponibles sur le marché ?
Le laboratoire Albion® a réalisé une étude comparative entre son bisglycinate de fer (Ferrochel®) et celui d’un autre fabricant, que l’on appellera « Compagnie F ».
Application de la méthode TRAACS
En comparant les spectres d’absorption de Ferrochel® et du bisglycinate de fer équivalent de la compagnie F, on remarque immédiatement l’absence de la bande caractéristique du cycle chélate (1600 cm-1) qui est une preuve incontestable de l’absence de vraie chélation.
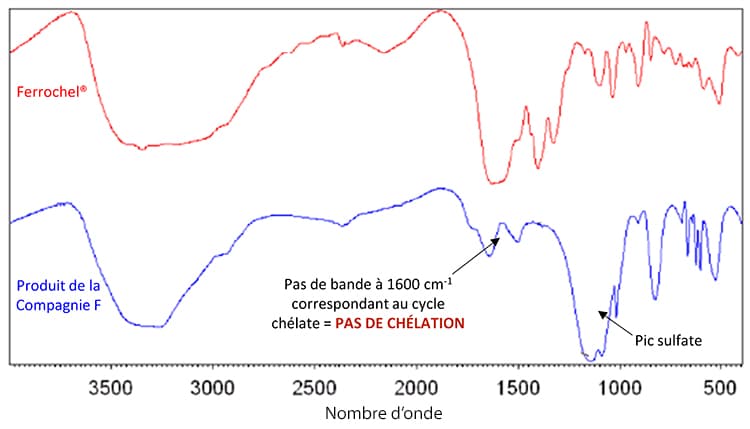
De plus, on observe la présence d’une bande forte et large supplémentaire (dans la zone des 1300 cm-1). La présence de ce pic signifie que le fer non chélaté ou partiellement chélaté est lié à des ions sulfates SO42- .

Suite à cette analyse, aucun doute ne subsiste sur le fait que le chélate du concurrent ne présente aucune forme de chélation possible entre le métal et la glycine.
Calcul du rapport molaire
Pour faire un double contrôle, des analyses complémentaires permettant de quantifier précisément le rapport molaire ont été réalisées sur les deux échantillons.
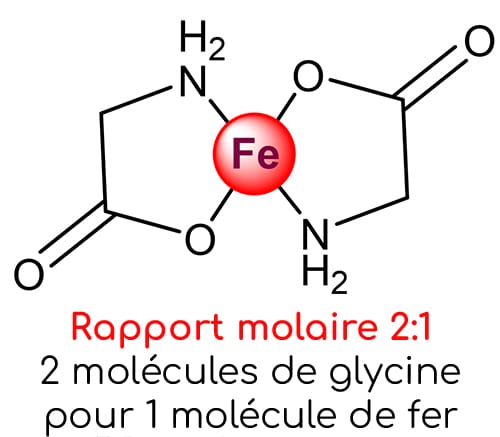
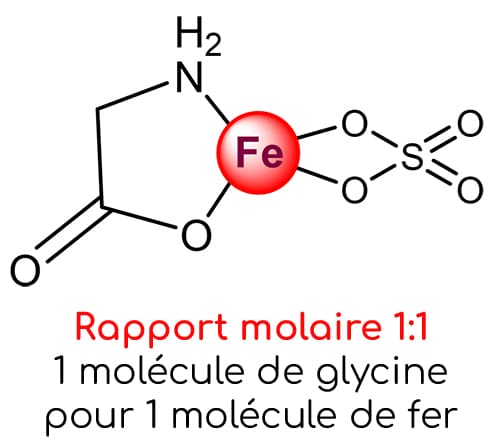

Ce constat est assez alarmant car il confirme que ce produit n’est pas un vrai chélate d’acides aminés au sens strict. La majorité des atomes de fer ne sont pas chélatés avec des glycines, alors même que ce complément est commercialisé en tant que bisglycinate de fer.
Analyse de la stabilité des chélates
Pour ne laisser aucun doute possible, une dernière analyse a été réalisée sur Ferrochel® et le produit de la compagnie F. Après les avoir mis en solution, chaque substance est passée au travers d’un filtre ultra fin permettant de dissocier ligand/métal si le métal n’est pas fortement chélaté par le ligand.
Si le taux de chélation est parfait, le métal ne doit pas se dissocier du ligand et on doit obtenir le même rapport molaire avant et après filtration. Si le métal n’est pas correctement fixé à l’acide aminé, les rapports molaires seront différents.
Pour le produit Ferrochel®, on obtient un rapport molaire de 2:1, avant et après la filtration, mais ce n’est pas le cas pour le produit de la compagnie F.
Dans ce dernier, le fer n’est donc pas correctement chélaté et les complexes sont instables, capables de se rompre lorsqu’ils sont passés au travers des filtres. Cela explique que le rapport molaire est différent après filtration.
L’analyse a également révélé la présence de cristaux de sulfate de fer (FeSO4), présence également constatée par l’analyse infrarouge (bande sulfate vers 1300 cm-1).
Conclusion
Comparaison des propriétés chimiques après une analyse fine des bisglycinates de fer de la marque Albion® (Ferrochel®) et de la compagnie F :
Bisglycinate de fer
Albion® (Ferrochel®)
Bisglycinate de fer C
Compagnie F
La compagnie F vante le pourcentage élevé de fer élémentaire (20%) de son produit, mais celui-ci est malheureusement retrouvé sous la forme de fer partiellement chélaté (rapport molaire 0,7 :1) ou de sulfate de fer (FeSO4).

Le chélate de fer de la compagnie F n’est donc pas un chélate au sens strict du terme, et il ne saurait donc être comparé au produit Ferrochel®, qui présente des paramètres pharmacocinétiques optimaux.

Mise en œuvre de la méthode TRAACS chez Nutrixeal pour un double contrôle qualité
Chez Nutrixeal, il nous tient à cœur de proposer des actifs de qualité premium. Il est donc inenvisageable pour nous de commercialiser des chélates d’acides aminés qui ne présentent pas des taux de chélation optimaux. C’est pour cela que nous nous fournissons auprès d’Albion® Minerals, leader mondial dans la production de minéraux chélatés par des acides aminés. Comme nous l’avons vu dans cet article, avec sa gamme TRAACS de minéraux et d’oligoéléments chélatés, Albion® garantit des compléments 100% chélatés soumis à un contrôle qualité rigoureux effectués à chaque lot de production.
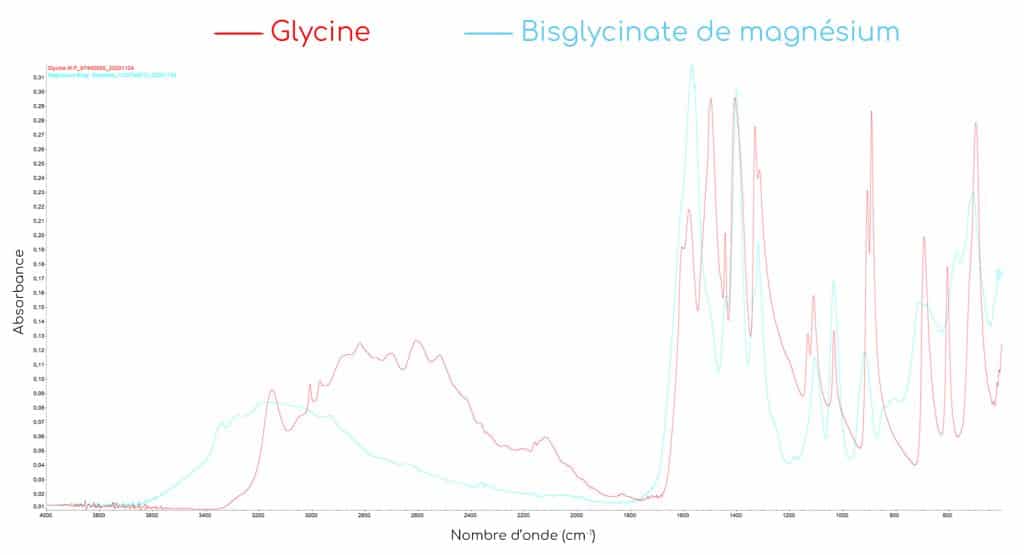
La facilité de la méthode TRAACS nous a permis au sein du laboratoire de contrôle de Nutrixeal de réaliser un double contrôle sur toute la gamme de minéraux, à savoir les bisglycinates de zinc, de cuivre, de fer et de magnésium.
À ce jour, toutes les analyses spectrales réalisées sur notre spectromètre infrarouge ont confirmé la chélation totale des minéraux.

Conclusion et avis Nutrixeal sur les minéraux chélatés et les analyses de contrôle intégrées dans la méthodologie TRAACS
L’application de la méthodologie TRAACS, développée par la société Albion® Minerals permet d’affirmer que beaucoup de minéraux présents sur le marché et présentés comme chélatés ne sont en réalité qu’un simple mélange de minéraux inorganiques et de glycine, bien loin de l’efficacité et de la sécurité d’emploi des minéraux labellisés TRAACS.

Si par le passé il vous est arrivé de rencontrer quelques difficultés digestives avec un produit à base de zinc, de magnésium ou de fer chélaté, c’est peut-être que les minéraux en question n’étaient tout simplement pas chélatés et ne contenaient en réalité que des minéraux sous forme inorganique !

Avec les minéraux chélatés proposés par Nutrixeal, vous avez en tout cas l’assurance que tous les atomes de zinc, de magnésium, de fer ou de cuivre sont solidement liés (et « encapsulés ») par des molécules de glycine.
Ces solides liaisons de coordination avec la glycine sont le gage d’une excellente assimilation intestinale et d’une parfaite tolérance digestive.
Nutrixeal applique par ailleurs la méthodologie de contrôle TRAACS (analyse par infrarouge) sur tous les lots de matière première pour tous ces minéraux. Nous sommes donc en mesure de nous engager à 100% sur la qualité de nos minéraux chélatés.

Pour aller plus loin : la méthode TRAACS en détails
La spectroscopie infrarouge : un nom technique pour une méthode d’analyse rapide et efficace
La méthode TRAACS utilise la spectroscopie infrarouge à transformée de Fourrier (FT-IR), une méthode d’analyse de routine pour caractériser des composés chimiques.
La spectroscopie infrarouge est une méthode d’analyse qui fournit une observation directe des groupements fonctionnels d’une molécule. Cet outil, sensible et facile à mettre en œuvre, est l’un des plus utilisés pour la caractérisation et l’identification des composés organiques.
La spectroscopie infrarouge utilise les propriétés vibrationnelles des molécules dans le but de facilement les caractériser. Les liaisons chimiques reliant deux atomes au sein d’une molécule ont en effet la capacité de bouger dans l’espace. Ces mouvements s’effectuent de façon coordonnée mais certaines liaisons s’allongent d’une façon quasiment indépendante du reste de la molécule, ce qui permet d’identifier des groupements fonctionnels particuliers au sein de la molécule.
À NOTER
Une liaison chimique peut bouger dans l’espace :
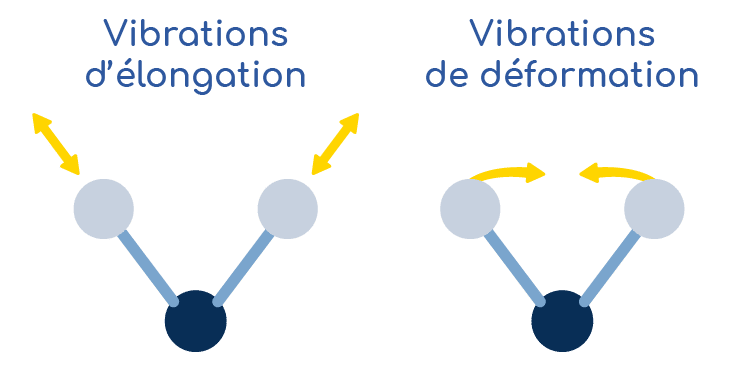
Pour vibrer, les liaisons chimiques ont besoin d’énergie. La quantité d’énergie nécessaire est directement liée à la nature de la liaison chimique : liaison forte ou faible, atomes de masses très différentes… Ainsi, plus une liaison sera forte, plus il faudra fournir d’énergie pour la mettre en mouvement.
Lors d’une analyse par spectroscopie infrarouge, l’énergie est apportée via un faisceau lumineux appartenant au domaine de l’infrarouge. La lumière traverse la molécule, ce qui la met en mouvement. Selon la nature chimique de la liaison, il faudra fournir plus ou moins d’énergie pour la faire vibrer : la liaison chimique absorbe l’énergie nécessaire transmise par la lumière à une longueur d’onde donnée. In fine, l’analyse permet d’obtenir un spectre d’absorption infrarouge caractérisé par des pics appelés « bandes d’absorption ». Chaque bande correspond à une radiation absorbée par la molécule. D’une manière générale, une bande d’absorption caractérise souvent une fonction particulière.
Mesure du taux de chélation via la méthode TRAACS
Généralement pour estimer un taux de chélation, on calcule un rapport molaire entre le ligand et le métal (rapport L:M où L est le ligand (c’est-à-dire ici l’acide aminé) et M le métal (ici : l’oligoélément)).
Dans la plupart des compléments alimentaires, le métal chélaté (zinc, fer, cuivre ou magnésium) a une valence de 2 c’est-à-dire qu’il va pouvoir se lier à deux résidus d’acides aminés. Le rapport molaire optimal de chélation sera alors noté 2:1 signifiant qu’une molécule de métal est liée à deux molécules de ligands. Un chélate d’acides aminés doit donc avoir un rapport molaire de 2:1 pour garantir un taux de chélation optimal, facteur clef d’une meilleure bioassimilation et d’une tolérance intestinale maximale.
Pour estimer ce taux, la méthode TRAACS compare les spectres d’absorption des acides aminés seuls et des chélates d’acides aminés. La chélation du métal engendre une modification des spectres notamment par la disparition ou le déplacement des bandes d’absorption caractéristiques du composé.
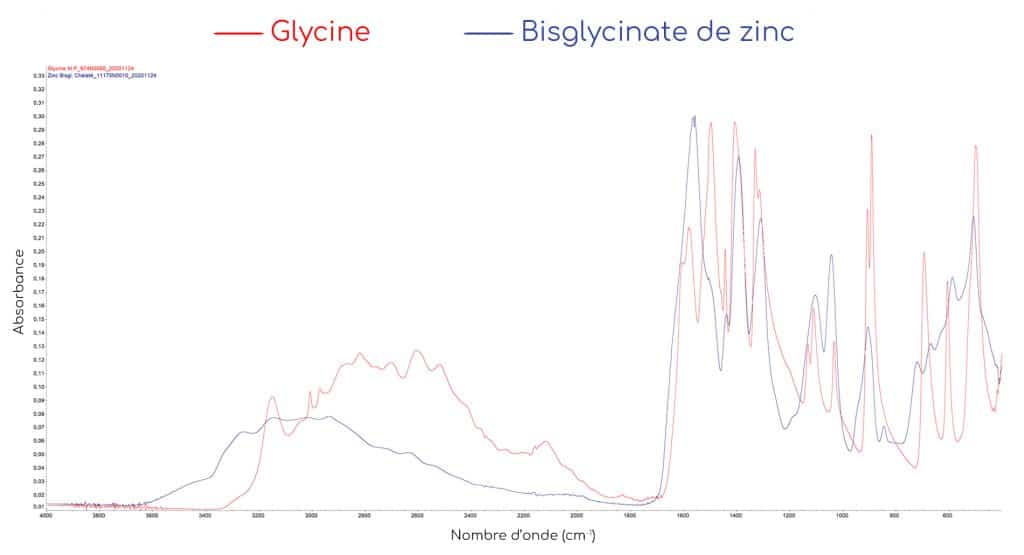
EXEMPLE DU BISGLYCINATE DE ZINC
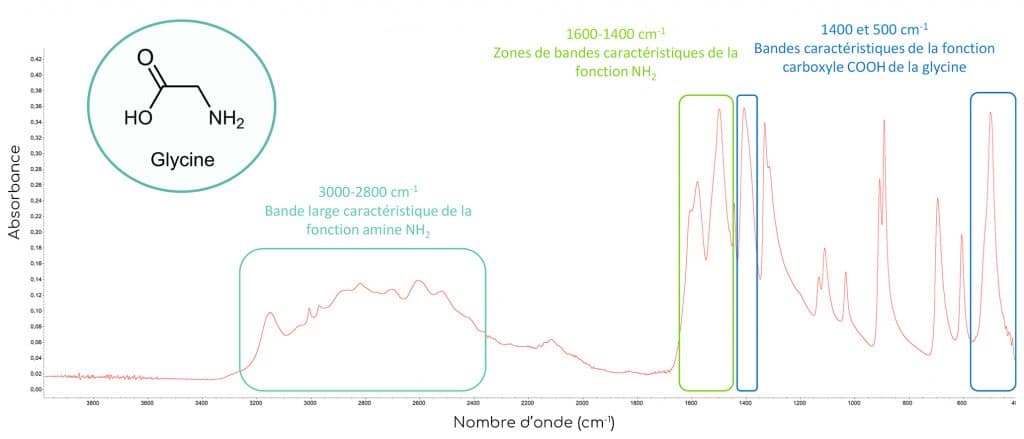
Pour bien comprendre les différences spectrales engendrées par la chélation du métal, nous allons tout d’abord analyser le spectre d’absorption de la glycine seule. En spectroscopie infrarouge, la glycine présente des bandes caractéristiques de ses fonctions amine NH2 et acide carboxylique COOH :
Lorsque les glycines emprisonnent le métal, l’environnement chimique ainsi que le type de liaisons chimiques changent ce qui induit des modifications spectrales significatives. On observe ainsi :
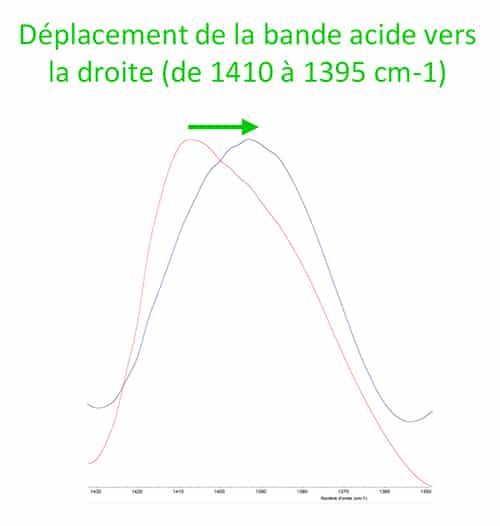
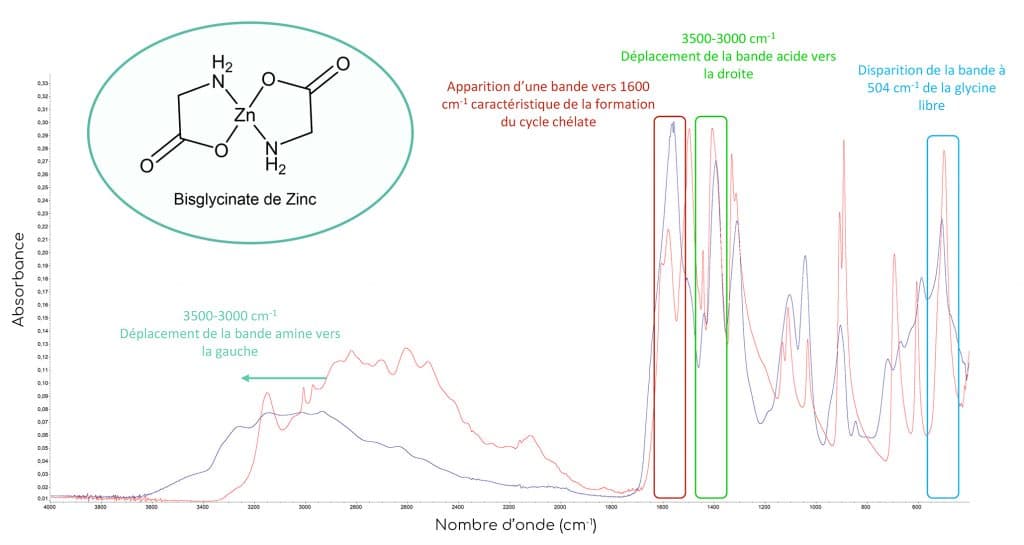
N.B : Sur le spectre du bisglycinate de zinc, on observe encore une bande d’absorption dans la zone des 500 cm-1. Le pic résiduel ne correspond pas au pic décrit précédemment pour la glycine libre, il s’agit probablement de la vibration de la liaison entre le métal et l’azote N. Le pic résiduel a d’ailleurs subi un léger déplacement vers la droite, ce qui signifie qu’il ne s’agit pas du pic à 504 cm-1 de la glycine libre.
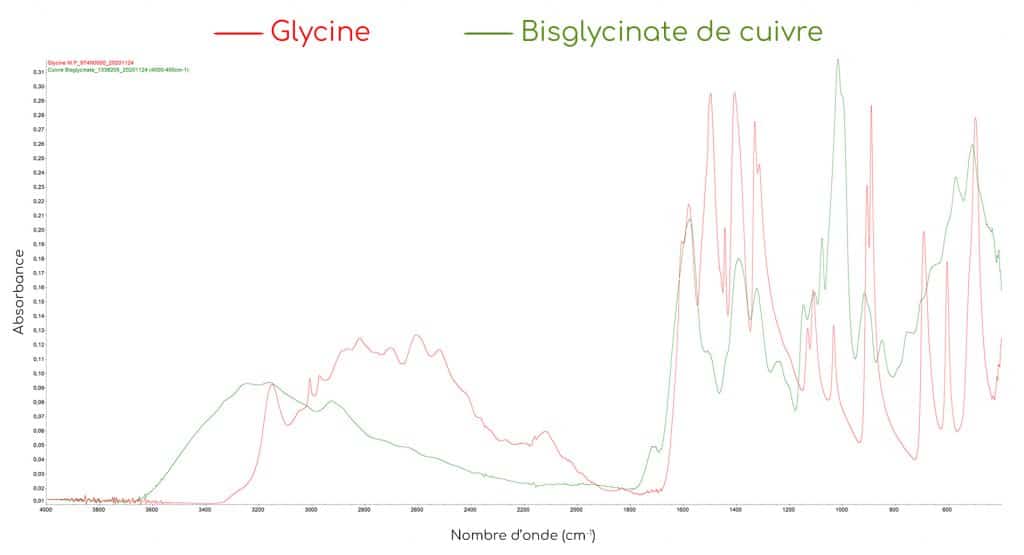
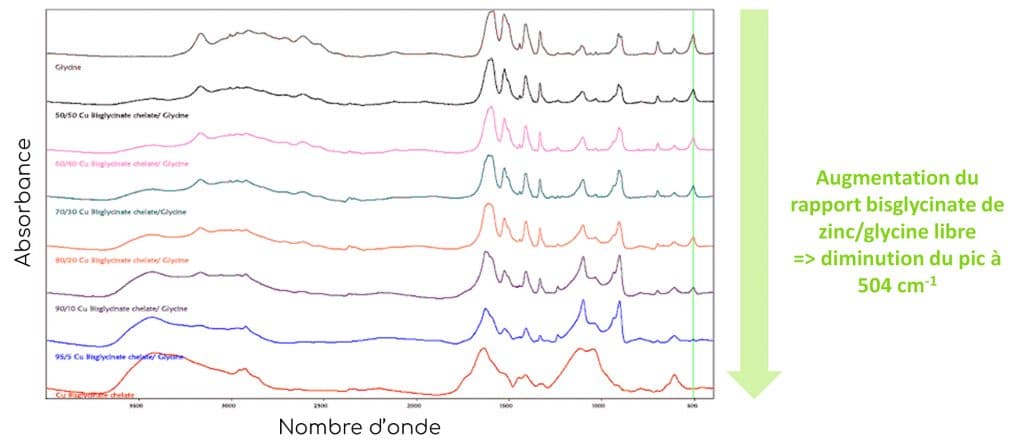
EXEMPLE DU BISGLYCINATE DE CUIVRE
Lorsque l’on réalise une analyse spectrale détaillée de plusieurs mélanges de bisglycinates de cuivre et de glycine libre avec des rapports chélate/glycine différents, on observe une disparition progressive de la bande à 504 cm-1. Cette bande est donc un indicateur efficace pour estimer le taux de chélation du complexe. Plus le rapport entre le bisglycinate de cuivre lié et la glycine libre augmente, plus l’absorbance à 504 cm-1 diminue. Il a effectivement été prouvé que le degré d’absorption de cette bande diminue au fur et à mesure que la quantité de glycine liée augmente.